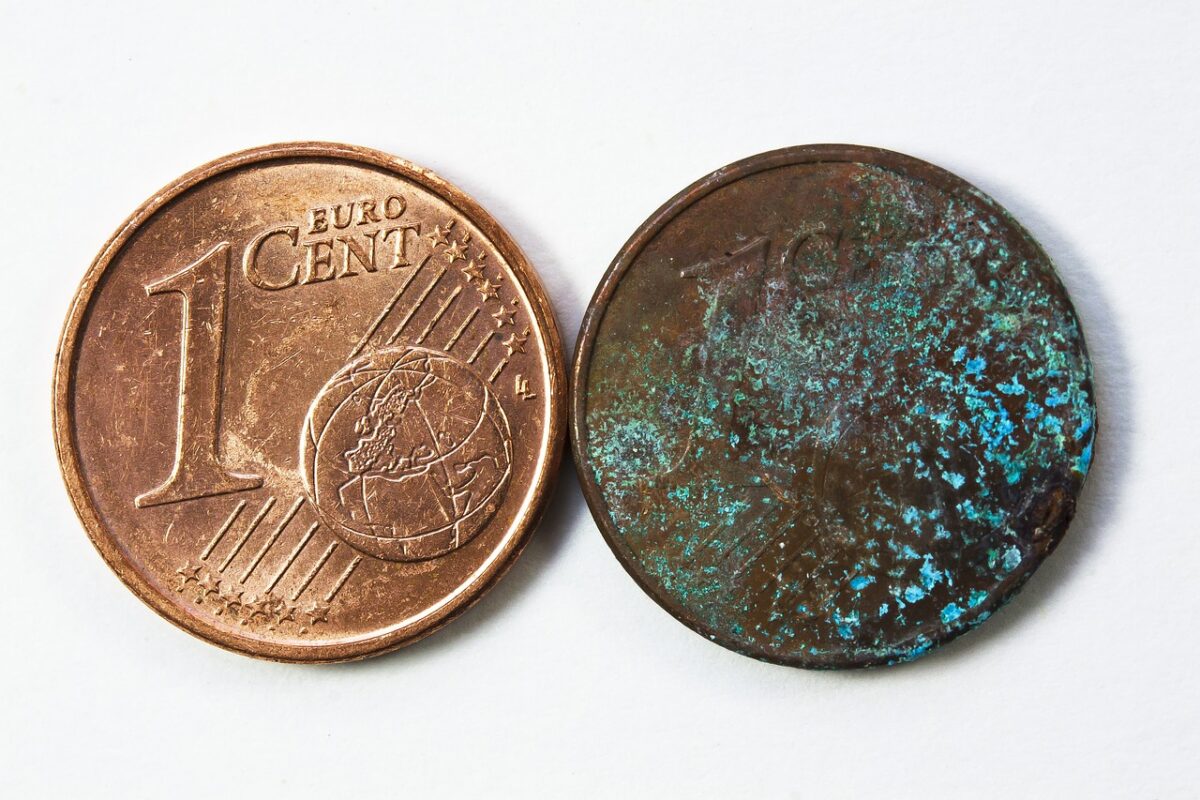Pourquoi le cuivre s’oxyde-t-il et devient-il vert ?
La couleur naturelle du cuivre est pêche ou blanc rosé, avec un éclat métallique brillant. C’est l’un des très rares éléments, dont la couleur naturelle n’est ni blanche ni grise. Cependant, il subit une réaction d’oxydation et devient vert après avoir été exposé à l’air.
Fait rapide
Un excellent exemple d’oxydation du cuivre est la Statue de la Liberté, où une couleur verte s’est développée sur la surface de la structure en raison de l’oxydoréduction, et non par effet des pluies acides, comme le croient généralement les gens. Selon eux, jusqu’à présent, l’oxydation de la peau de cuivre de la statue est d’environ 0,005 pouce.
Le cuivre est un élément métallique de numéro atomique 29, représenté par le symbole ‘Cu’ (Cuprum). C’est un élément malléable (qui peut être façonné en une feuille mince) et ductile (qui peut être façonné en un fil mince). Chez les humains et les animaux, c’est un métal essentiel que l’on retrouve dans les cellules et les tissus du corps. En raison de sa grande conductivité thermique et électrique, le cuivre est utilisé dans de nombreux aspects de la vie, comme les matériaux de construction, les conducteurs thermiques et électriques, et dans la fabrication de divers alliages métalliques. En fait, on peut faire remonter son utilisation à l’Antiquité et aux premières civilisations. C’est ce que révèlent les vieux objets d’artisanat en cuivre, les objets en cuivre et d’autres vestiges matériels des civilisations passées. En raison de ses propriétés chimiques, le cuivre occupe la troisième place parmi les métaux industriels, après l’aluminium et le fer. Dans la nature, le cuivre se trouve généralement en association avec le soufre, qui est ensuite purifié par d’autres techniques.
Exemples d’oxydation
L’oxydation du fer est appelée « rouille «, et elle entraîne la corrosion et la formation d’une couche extérieure rouge-brun écaillée.
Un autre exemple est l’oxydation de l’aluminium, qui entraîne le développement d’une couche blanche écaillée. On observe généralement ce phénomène sur les portes et les fenêtres en aluminium après de fortes pluies. Lorsqu’une pomme est coupée et que sa surface est exposée à l’air, elle devient brune.
Oxydation du cuivre et changement de couleur
L’oxydation est un phénomène, par lequel un élément perd des électrons (et/ou de l’hydrogène) en interagissant avec un autre élément. Comme le fer et l’aluminium, l’élément cuivre subit le processus d’oxydation, s’il est exposé à l’air. Si l’atmosphère est constituée d’une forte humidité, ce processus est plus rapide. Le cuivre métallique réagit avec l’oxygène, ce qui entraîne la formation d’une couche externe d’oxyde de cuivre, de couleur verte ou vert bleuté. Cette couche est connue sous le nom de patine.
Contrairement à d’autres processus d’oxydation destructeurs, la patine agit comme une couche protectrice, et elle ne provoque aucune faiblesse du métal. Ainsi, le cuivre est considéré comme un élément important qui résiste à la corrosion. La patine empêche la poursuite de la corrosion du cuivre sous la couche oxydée. Très souvent, cette couche est observée sur les toits des vieux bâtiments, et agit comme une couche d’imperméabilisation et de protection solaire.

Réactions
☞ Le processus d’oxydation se caractérise par la formation de trois produits principaux : l’azurite, la malachite et la brochantite. Ces minéraux confèrent la couleur bleu-vert caractéristique au cuivre métallique oxydé et forment la couche de patine. En termes simples, il s’agit d’une réaction d’oxydoréduction dans laquelle l’oxydation et la réduction ont lieu en même temps.
☞ Tout d’abord, le cuivre donne des électrons en réagissant avec l’oxygène pour former de l’oxyde de cuivre, qui est de couleur brun rougeâtre. Cela peut être représenté comme suit :
4Cu + O2 = 2Cu2O (oxyde de cuivre) — équation 1
☞ Cu2O réagit à nouveau avec l’oxygène pour former CuO, de couleur noire :
2Cu2O + O2 = 4CuO — équation 2
☞ L’atmosphère est également constituée de divers polluants comme le dioxyde de soufre, le monoxyde de carbone, le dioxyde de carbone, etc. Dans les zones où la combustion du charbon a lieu, les fumées de soufre sont présentes à grande échelle, car le soufre est une impureté présente dans la plupart des types de charbon. L’oxyde de cuivre réagit avec cet élément pour former du sulfate de cuivre de couleur bleue, qui peut en outre réagir avec le dioxyde de carbone et l’humidité présente dans l’air pour former la couche de patine.
Alternativement, l’oxyde de cuivre peut également réagir directement avec CO2, H2O et les oxydes de soufre pour former les composés brochantite, malachite et azurite :
☞ La brochantite se forme principalement en présence d’un niveau élevé de fumées de soufre. Elle est de couleur verte, et est également connue sous le nom de sulfate de cuivre hydraté.
4CuO + SO3 + 3H2O = Cu4SO4(OH)6 (brochantite) — équation 3
☞ La malachite est un composé de couleur verte, formé naturellement, et avec l’azurite, elle comprend des pierres minérales semi-précieuses de couleur vert-bleu connues sous les mêmes noms. Cela indique que l’oxydation du cuivre a également lieu dans les roches et les pierres précieuses formées naturellement, en dehors des ustensiles en cuivre, des statues, des toits, etc.
2CuO + CO2 + H2O = Cu2CO3(OH)2 (malachite) — équation 4
☞ L’azurite est également connue sous le nom de carbonate de cuivre hydraté, et elle confère une légère teinte bleutée au métal oxydé. Elle se forme près des zones exploitées pour le cuivre.
3CuO + 2CO2 + H2O = Cu3(CO3)2(OH)2 (azurite) — équation 5
Comment oxyder le cuivre
Il existe plusieurs méthodes pour oxyder le cuivre à la maison en utilisant des éléments essentiels du quotidien comme le sel, l’ammoniac de cuisine, le bicarbonate de soude, l’eau, etc. Grâce à cette technique, vous pouvez conférer un aspect antique ou de style ancien à vos objets en cuivre désirables, comme les pièces de monnaie, les médailles, les pièces de vitrine, etc. :
- Tout d’abord, nettoyer le métal en cuivre avec un détergent doux et de l’eau, et essuyez uniformément dans une seule direction.
- Dans un ustensile en acier, mélanger environ une demi-cuillère à soupe de sel, une demi-cuillère à soupe de bicarbonate de soude, et environ 15 oz d’ammoniac dans un demi-litre d’eau.
- Remplir cette solution dans un flacon pulvérisateur et pulvérisez l’article en cuivre au moins une fois dans un jour. Après quelques semaines, une patine de couleur verte commencera à couvrir la surface du métal.
- Il est préférable d’effectuer cette technique à l’extérieur pour obtenir des couches de carbonate plus lisses et se développant plus rapidement.
- Pour oxyder des objets plus petits comme des pièces de monnaie en cuivre, une méthode plus simple consiste aux suspendre dans un bocal sans toucher les côtés et le fond.
- Elles doivent être nettoyées avec de l’alcool et lavées avec du détergent avant des attacher au bocal avec un fil.
- Le fond du bocal est rempli d’un demi-centimètre d’ammoniac, et lorsque les vapeurs commencent à atteindre la surface du cuivre, fermez le bocal avec un couvercle.
- En quelques heures, une couche verte claire commence à se former sur leur surface. Dévissez le couvercle et retirez les pièces après l’apparition d’une épaisseur de patine souhaitable.
Pour prévenir l’oxydation, les pièces doivent être protégées contre l’oxydation.
Pour prévenir l’oxydation, le meilleur moyen est de protéger les surfaces, qui sont susceptibles d’être exposées à l’air et à l’eau, à l’aide d’une couche protectrice. De cette façon, on empêche la surface métallique de réagir avec l’oxygène et/ou l’eau. Vous pouvez également appliquer du citron sur la surface du cuivre afin d’éliminer toute couche de patine de carbonates qui s’est formée sur les objets oxydés.
Une façon très efficace de nettoyer les grands ustensiles en cuivre, les statues de vitrine, les tuyaux, etc. consiste à plonger dans une solution composée d’eau, de vinaigre et de sel de table. Faites chauffer l’eau jusqu’à ébullition et laissez les objets immergés pendant quelques heures. Après les avoir retirées, nettoyez les articles avec du savon ou du détergent pour retrouver la couche de cuivre brillante.